بیوشیمی ( هموگلوبین و سایر پروتعین های بدن )
13 آذر 1404
ارسال شده توسط peroda
هموگلوبین و سایر پروتعین های بدن
در بدن انسان هزاران پروتعین مختلف وجود دارد که در تمامی فرایند های سلولی دخالت دارند .
علت تنوع پروتعین ها عبارتند از :
1- اختلاف در توالی آمینواسید های زنجیره پلی پپتید
2- تغییرات پس از ترجمه برخی ریشه های آمینواسید موجود در زنجیره پلی پپتید
3- اتصال گروه های غیر آمینواسیدی به زنجیره های پلی پپتیدی

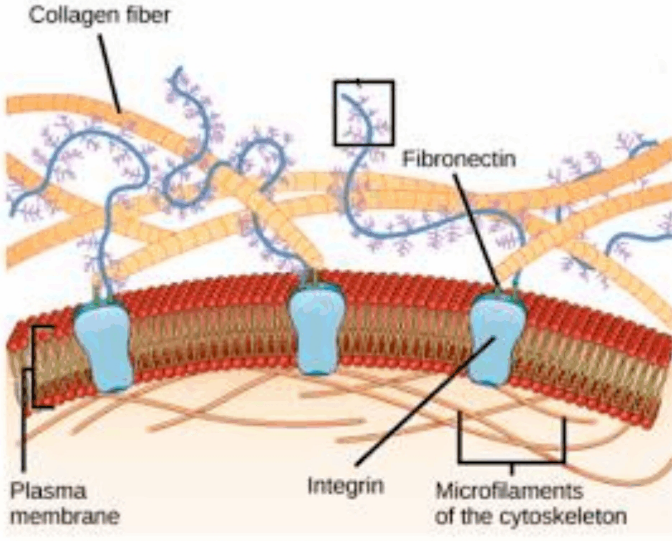
پروتعین های ساختمانی : پروتعین های رشته ای هستندکه دارای قدرت یا انعطاف پذیری بالایی بوده و اغلب در ایجاد ماتریکس خارج سلولی نقش دارند.
1- کلاژن
2- الاستین
3- کراتین a
کلاژن :
پروتعین رشته ای است که بیشترین جزء پروتعینی بافت همبند پستانداران را تشکیل می دهد و تقریبا در تمامی بافت های پستانداران وجود دارد.
مهم ترین ماده ی آلی بافت استخوان را تشکیل می دهد.
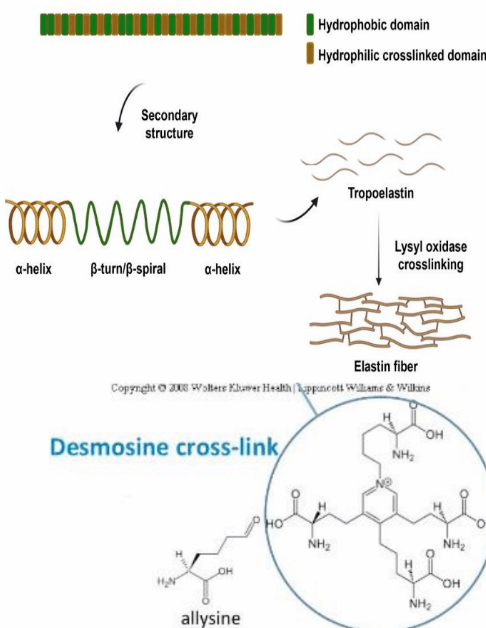
کلاژن نوعی گلیکوپروتعین است و در ساختار خود دسموزین ( 4 ریشه لیزین دسموزین را میساختند) دارد.
فراوان ترین کلاژن موجود در استخوان ها ، کلاژن نوع 1 و در غضروف
نوع 2 است.
نقص در سنتز کلاژن از علل مهم ناهنجاری های عروقی ، پوستی ، استخوانی و غضروفی است.
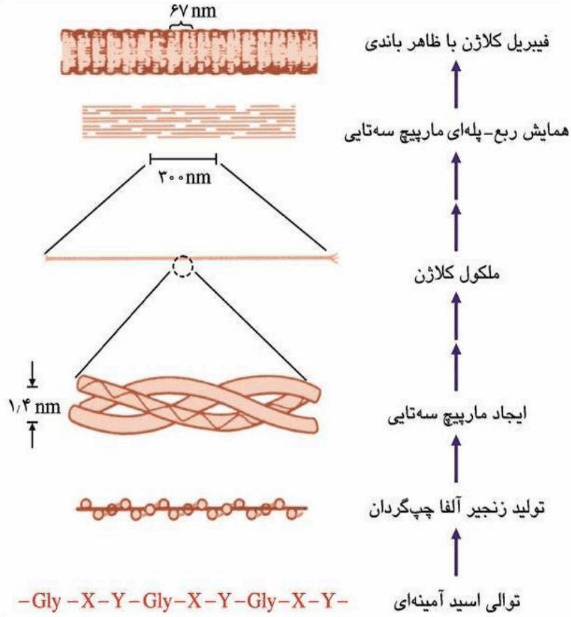
کلاژن یک مارپیچ سه تایی هموتریمری(یعنی سه زنجیره از یک نوع ) است و زنجیرهای تشکیل دهنده آنها توسط حدود 40 ژن مختلف کد می شوند.
تمامی انواع کلاژن ها یک ساختمان دوم بی همتای مارپیچی دارند که از سه نظر با مارپیچ a متفاوت می باشد :
1- چپ گردان است ( هر زنجیره پلی پپتیدی منفرد کلاژن چپ گرد است اما سه زنجیره کنار هم و ساختار نهایی کلاژن راست گرد است)
2- پیوند هیدروژنی درون زنجیری ندارد ( دوباره راجب تک زنجیره کلاژن اینطور است و در ساختار نهایی پیوند هیدروژنی داریم)
3- در هر دور آن 3 آمینواسید وجود دارد
توالی عمومی به شکل یک واحد تکراری تری پپتیدی به صورت Gly-X-Y است که موقعیت های X و Y را اکثراً
پرولین تشکیل می دهد و بیشتر پرولین قسمت Y به
هیدروکسی پرولین تغییر می یابد.
بدین ترتیب حدود 35 درصد کلاژن را گلایسین و
21 درصد آن را پرولین و هیدروکسی پرولین تشکیل می دهد.

سه زنجیره a کلاژن به شکل راست گردان حول یکدیگر پیچیده و تولید ابرمارپیچ سه تایی می کنند که قدرت کششی بالایی دارد .
ابرمارپیچ سه تایی کلاژن توسط پیوند های هیدروژنی بین زنجیری پایدار می شود .
سنتز کلاژن در دو مرحله داخل سلولی و خارج سلولی انجام می شود.
سنتز کلاژن داخل سلولی :
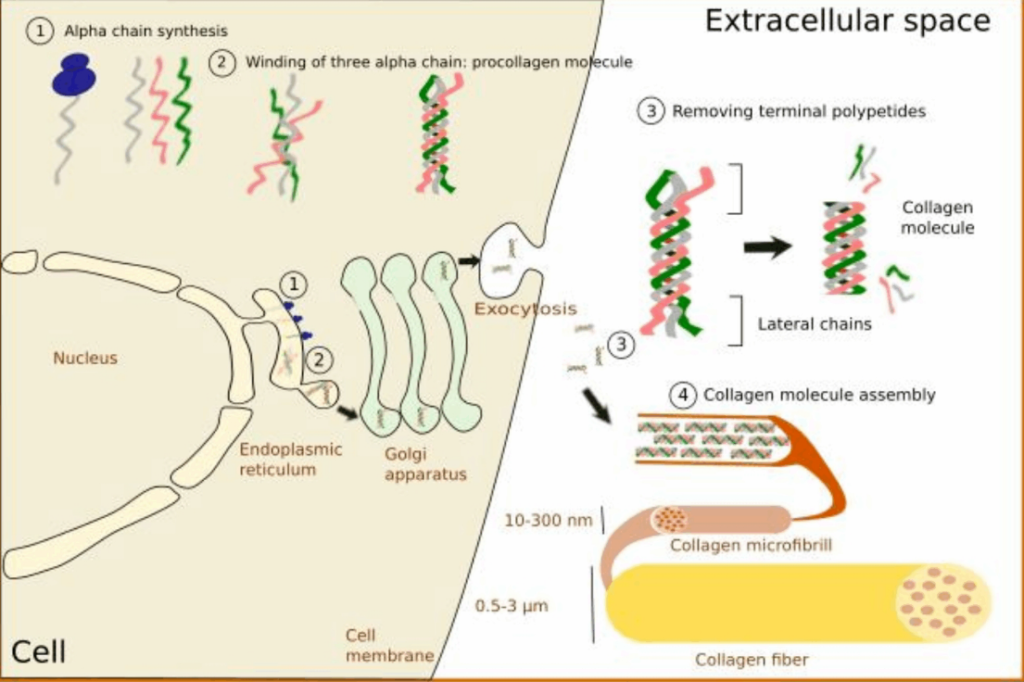
+ کلاژن یک پروتعین ترشحی است و برروی ریبوزوم های شبکه آندوپلاسمی زبر( RER) به صورت پیش ساز پروکلاژن سنتز می گردد.
+ هر رشته پروکلاژن 1500 آمینواسید دارد.
+ در دو انتهای پروکلاژن ، قطعات اضافی به نام پروپپتید های انتهای آمینو و انتهای کربوکسیل وجود دارند که فاقد توالی لازم برای ایجاد ساختمان مخصوص کلاژن هستند.
+ سه رشته پروکلاژن به دور هم پیچیده و تولید یک مارپیچ سه تایی می کنند.
+ پرو پپتید های ساختمان های کروی را به وجود می آورند که ایجاد پیوند های دی سولفیدی درون زنجیری و بین زنجیری می کنند.
+ پروکلاژن پس از بسته بندی در وزیکول های ترشحی دستگاه گلژی به خارج سلول ترشح می شود.
+ در داخل شبکه آندوپلاسمی توالی پیام برداشت شده و پروکلاژن حاصل متحمل تغییرات پس از ترجه میشود :
1- هیدروکسیلاسیون ریشه های پرولین و لیزین به هیدروکسی پرولین و هیدروکسی لیزین
2- گلیکوزیلاسیون ریشه های هیدروکسی لیزیل

سنتز کلاژن خارج سلولی :
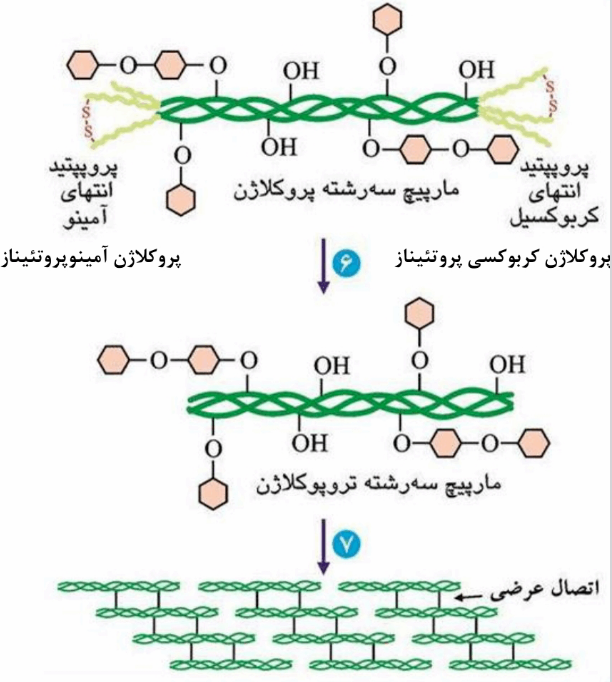
+ پروتعاز های خارج سلولی شامل پروکلاژن آمینوپروتعیناز و پروکلاژن کربوکسی پروتعیناز با برداشت قطعات اضافی ، کلاژن را تولید می کنند که در هر زنجیر آن حدود 1000 آمینواسید (ابتدا 1500 تا بود ) وجود دارد.
+ بخش اصلی توالی اسیدآمینه ای این زنجیر ها ( حدود 600 آمینواسید از 1000 آمینواسید) دارای توالی سه تایی پشت سر هم GI-X-Y است.
+ قطعات انتهایی فاقد این توالی تکراری را تلوپپتید های انتهای آمینو و کربوکسیل می گویند.
+ واحد های مولکولی سه رشته ای که در ایجاد فیبر های کلاژن به کار می روند را تروپوکلاژن میگویند که 3000 آمینو اسید دارد. ( سه رشته 1000 تایی)
+ پرو پپتید های ساختمان های کروی را به وجود می آورند که ایجاد پیوند های دی سولفیدی درون زنجیری و بین زنجیری می کنند.
+ پروکلاژن پس از بسته بندی در وزیکول های ترشحی دستگاه گلژی به خارج سلول ترشح می شود.
+ در هنگام تولید واحد های ساختمانی مارپیچ سه رشته تروپوکلاژن بالغ ، پروپپتید های انتهای آمینو و انتهای کربوکسیل از مارپیچ سه رشته پروکلاژن جدا می شوند.
+ در دو انتهای تروپوکلاژن تلوپپتید های انتهای آمینو و کربوکسیل وجود دارند که در هنگام تجزیه کلاژن بالغ آزاد می شوند.

هیدروکسی لیزین محل اتصال زنجیره کربوهیدرات به کلاژن است.
هیدروکسی پرولین با ایجاد پیوند هیدروژنی باعث استحکام کلاژن می شود.
کمبود ویتامین C موجب بیماری اسکوروی می شود ، که باعث اختلال در تشکیل کلاژن می شود.
پروتامین یکی از قلیایی ترین پروتعین ها است و کارش مثل هیستون هاست و در زمان تقسیم سلولی جای هیستون را میگیرد.
واکنش لیزیل اکسیداز :
+ برای اینکه الیاف کلاژن و الاستین در بدن محکم و پایدار شوند ، باید بین رشته های آنها اتصال های عرضی تشکیل شود. آنزیمی به نام
لیزیل اکسیداز این کار را انجام می دهد.
+ این آنزیم وابسته به
مس است.
+ لیزیل اکسیداز گروه آمینی در انتهای زنجیره ی لیزین را اکسید می کند و آن را به یک گروه آلدهید تبدیل می کند که به لیزین تبدیل شده
آلیزیل می گویند.
+ این گروه آلدهید جدید می تواند با آلدهید های دیگر یا با آمین های دیگر واکنش دهد و اتصال های عرضی قوی بین رشته های مختلف کلاژن و الاستین بسازد.
+ کمبود آنزیم لیزیل اکسیداز باعث بیماری
منکس(menkes) می شود. ( کمبود مس نیز می تواند این بیماری را ایجاد کند )
خلاصه داستان : 1- لیزیل اکسیداز لیزین را به آلدهید تبدیل می کند 2- آلدهید ها باهم پیوند می زنند 3- فیبر های کلاژن و الاستین محکم می شوند

اختلالات عمده در رابطه با متابولیسم کلاژن :
1- خودکشی پروکلاژنی : وقتی یک زنجیر غیرطبیعی با دو زنجیر طبیعی ایجاد مارپیچ سه تایی می کند ، ممکن است ساختمان این مارپیچ طبیعی نبوده و دچار تخریب آنزیمی شود.(بیماری ژنی)
2- سندروم آلپورت : باعث بیماری کلیوی و وجود خون در ادراد می شود. (بیماری ژنی)
3- آسکوربوت : به دلیل کمبود اسکوربات سبب اختلال در ساختمان کلاژن می گردد. علاعم اصلی این کمبود شامل ، خونریزی از لثه ، خونریزی های زیر پوستی ، بهبود آهسته زخم ها می باشد. اختلال در سنتز کلاژن ناشی از کمبود فعالیت دو آنزیم پرولیل هیدروکسیلاز و لیزیل هیدروکسیلاز است که هردو نیاز به اسکوربات به عنوان کوفاکتور دارند ، باعث این بیماری است.(غیر ژنتیکی)
4- اسکوروی : به علت کمبود ویتامین C
5-استعوژنز ایمپرفکتا ( استخوان زایی ناقص) : استخوان ها به طور غیر طبیعی شکننده هستند.(بیماری ژنی)
6- سندرم اهلرز : شلی زیاد مفاصل و شکنندگی بافت ها ( بیماری ژنی)
الاستین :
از پروتعین های بافت همبند است و مسعول قابلیت ارتجاعی و برگشت الاستیک به حالت اولیه بافت های ریه ، دیوار شریان ها ، پوست و رباط ها می باشد. .
الاستین :
1- فاقد تنوع ژنتیکی
2- فاقد توالی تکراری سه آمینواسیدی
3- فاقد ساختمان دوم منظم
4- فاقد بخش کربوهیدراتی
5- فاقد هیدروکسی لیزیل بوده و به شکل تروپوالاستین سنتز می شود.
هر مولکول رشته ای الاستین از طریق ساختار هایی به نام دسموزین به یک الاستین دیگر متصل می شود و به این طریق شبکه ای از مولکول های الاستین ایجاد می شود.
اتصال دسموزین در پروتعین های کلاژن و الاستین توسط آنزیم لیزیل اکسیداز ساخته می شود.
سندرم ویلیامز به علت نقص در الاستین ایجاد می شود و بر روی نمو بافت همبند و سیستم عصبی مرکزی اثر دارد.
کراتین :
در مو ، ناخن و لایه خارجی پوست وجود دارد .
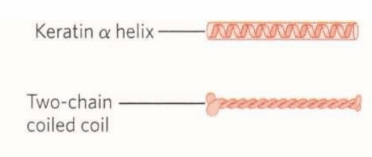
از یک مارپیچ a راست گردان تشکیل می شود .
دو رشته از این مارپیچ a به طور موازی همسو به شکل چپ گردان حول یکدیگر می پیچند تا دیمر فنر فنری شده را ایجاد کنند.
سطح تماس دو مارپیچ متشکل از ریشه های آبگریز میباشد لذا در کراتین a ، اسید های آمینه ، آلانین ، والین ، لوسین ، ایزولوسین ، متیونین و فنیل آلانین فراوان هستند .
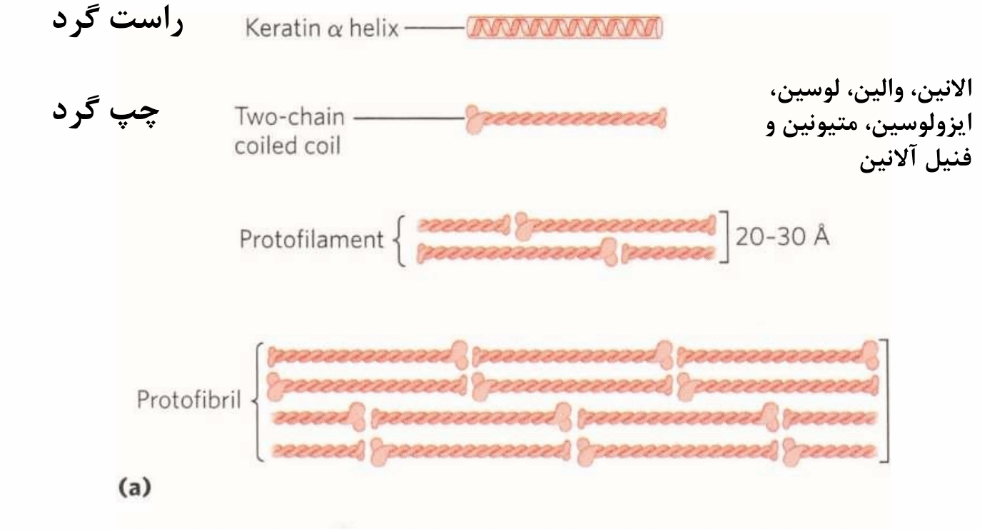
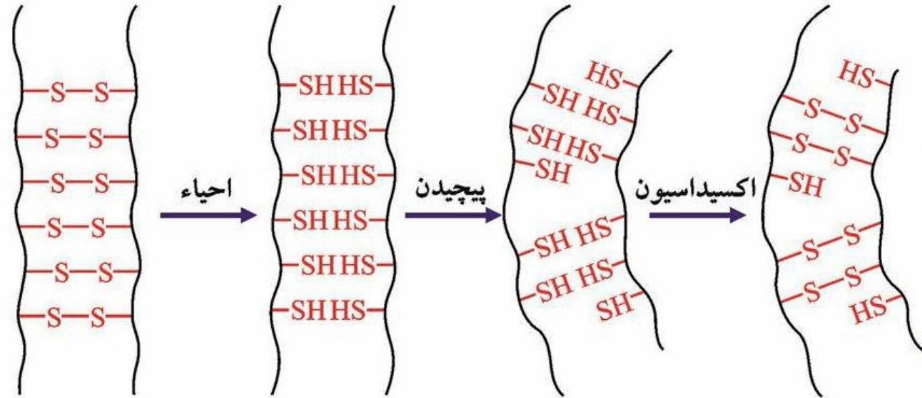
میزان سیستعین کراتین بالا است که ایجاد اتصالات عرضی دی سولفیدی را فراهم می سازد .
حذف پیوند های دی سولفیدی کراتین در مو توسط عوامل احیاء کننده و سپس پیوند های جدید در موقعیت های جدید اساس تغییر کونفورماسیون کراتین و در نتیجه تغییر شکل مو در هنگام ایجاد فر داعمی مو می باشد .
انواع هموگلوبین :
1)
HbA1 یا HbA : هموگلوبین طبیعی بالغین و دارای ترکیب a2B2 است که اکثریت هموگلوبین خون را تشکیل می دهد.
2)
HbA2 : هموگلوبین فرعی بالغین است و مقدار کمی از هموگلوبین خون را تشکیل می دهد. مقدار این هموگلوبین در B- تالاسمی ها افزایش پیدا می کند.
3)
HbF : هموگلوبین جنینی و دارای ترکیب a2y2 است و هموگلوبین غالب نوزاد در هنگام تولد HbF است. (HbF تمایل بیشتری به اکسیژن نسبت به HbA دارد)
4)
HbE : هموگلوبین دوران رویانی ( قبل از دوران جنینی) است که در ابتدای دوران جنینی تماماً به HbF تبدیل می شود.هموگلوبین غالب تا پایان سه ماهه اول بارداری هموگلوبینE است.
5)
HbS : هموگلوبین آنمی داسی شکل است. در این نوع هموگلوبین ، آمینواسید والین جایگزین گلوتامیک اسید زنجیره یB هموگلوبین می شود.
6)
HbM : حاصل یک جایگزینی آمینواسیدی در نزدیکی گروه هِم است که سبب پایداری غیر معمول آهن فریک(+Fe3) و تولید متهموگلوبین می شود که قادر به انتقال اکسیژن نیست.
7)
HbC : نوع دیگری از هموگلوبین غیرطبیعی است که در آن لیزین جایگزین گلوتامات در زنجیره B شده و در این حالت پلیمریزاسیون هموگلوبین رخ نمی دهد.
در هموگلوبین HbA قوی ترین تعاملات بین زیرواحد های غیر یکسان نظیر a1B1 و a2B2 رخ می دهد.
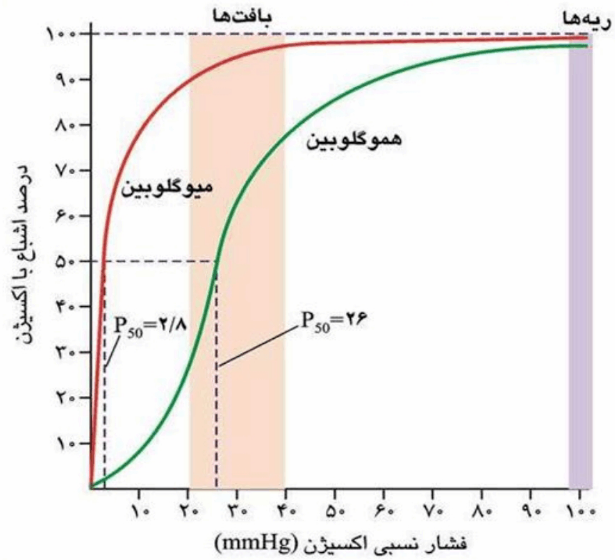
منحنی اشباع اکسیژن در میوگلوبین به صورت سهمی اما در هموگلوبین به شکل
سیگموعید است.
برای اشباع هموگلوبین از اکسیژن به فشار اکسیژن بیشتری نیاز است.
HbA1c یا هموگلوبین گلیکوزیله :
+ گلوکز خون پس از ورود به RBC ، تعداد کمی از هموگلوبین ها را گلیکوزیله می کند.
+ به طور طبیعی نسبت هموگلوبین گلیکوزیله به طبیعی حدود 5 درصد است.
+ میزان هموگلوبین گلیکوزیله می تواند شاخص خوبی از میانگین غلظت قند خون طی چند هفته ی گذشته باشد و اندازه گیری آن ، اطلاعات مفیدی درباره ی درمان دیابت قندی و کنتل آن در اختیار می دهد.
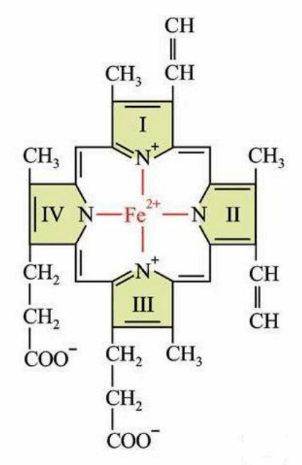
هر زیرواحد از هموگلوبین ، از یک زنجیره ی پروتعینی به نام گلوبین و یک بخش غیر پروتعینی به نام
هِم تشکیل شده است.
هر مولکول هِم از یک حلقه ی پروتوپورفیرین (متشکل از چهار حلقه ی کوچک پیرول = تتراپیرول) و یک اتم
آهن (+Fe2) تشکیل شده است.
مولکول هِم :
ساختمان فضایی و پیچ و تاب خورده ی گلوبین که تقریباً حالت کروی به خود میگیرد به گونه ای است که آمینواسید های هیدروفیل نزدیک به سطح و آمینواسید های هیدروفوب در
مرکز آن قرار میگیرد
هر اتم آهن موجود در هِم می تواند به یک مولکول اکسیژن متصل شود. ( یک هموگلوبین = 4 هِم + 4 حلقه ی پورفیرین + 4 گلوبین )
اتم آهن هِم 6 پیوند کوعوردینانس ایجاد می کند :
4 پیوند با اتم هاب نیتروژن حلقه تتراپیرولی پروتوپرفورین ،
1 پیوند با حلقه ایمیدازول هیستیدین و
1 پیوند با اکسیژن
هموگلوبین در خون به دو صورت
R(Relax) و T(Tense) وجود دارد.
برقراری پل های نمکی بین زنجیره های پروتعینی هموگلوبین باعث تبدیل فرم R به فرم T می شود.
در مجاورت آلوعول های ریوی ، در ابتدا هموگلوبین به فرم T ( دارای پل های نمکی) و خالی از اکسیژن وجود دارد که میل کمی به
O2 دارد.
به محض اتصال اولین مولکول O2 به هموگلوبین ، پل های نمکی تدریجاً شروع به شکسته شدن می کنند و میل ترکیبی هموگلوبین برای اتصال با سه مولکول O2 دیگر چند صد برابر افزایش می یابد.
گذار از فرم T به فرم R پس از اتصال اولین O2 اتفاق نمی افتد بلکه با هر مرحله ی اتصال O2 محتمل تر می شود ؛ با این حال اتصال اولین O2 تأثیر به مراتب بنیادی تری در گذار از فرم T به فرم R دارد.
در مجاورت بافت ها نیز اکسیژن از هموگلوبین خارج شده و فرم R هموگلوبین به فرم T تبدیل می شود که باعث خروج O2 بیشتر از هموگلوبین و تحویل آن به بافت ها می شود.
در ریه بیشتر هموگلوبین با فرم R و در کنار بافت ها بیشتر به فرم
T وجود دارد.
کمبود آلفا1-آنتی تریپسین باعث ایجاد بیماری آمفیزم ریوی می شود.
در هموگلوبین جایگاه های اتصال متفاوتی برای H وجود دارد که تمایل این جایگاه ها در داکسی هموگلوبین بیشتر از اکسی هموگلوبین است.
در غلظت بالای H این یون ها به هموگلوبین متصل و تمایل آن را به اکسیژن کاهش می دهد.
آلکالمی حاد : به حالتی گفته می شود که PH خون به طور ناگهانی بالاتر از محدوده طبیعی می رود.
هایپوکسی : به وضعیتی گفته می شود که با کمبود اکسیژن در بافت ها یا خون مشخص می شود.

منحنی اشباع هموگلوبین :
انتقال کربن دی اکسید از بافت به ریه :
حدود 5 - 10 درصد CO2 به شکل محلول در پلاسما منتقل می شود.
حدود 15 - 20 درصد CO2 به شکل کربامینو هموگلوبین منتقل می شود.
حدود 70 - 80 درصد CO2 به شکل بیکربنات منتقل می شود.
در سطح ریه فشار اکسیژن بالا است، O2 با هموگلوبین ترکیب شده و منجر به آزادسازی +H میشود که در دفع ریوی CO2 کمک میکنند. نقش O2 در دفع ریویCO2 را اثر هالدان گویند.
در سطح مویرگ غلظت بالای CO2 و +H آزاد سازی O2 از هموگلوبین و تولید داکسی هموگلوبین را تسریع می کند. این را اثر بوهر گویند.
انتقال اکسید نیتریک توسط هموگلوبین :
+ اکسید نیتریک( NO) یک متسع کننده عروقی و مهارکننده تجمع پلاکتی است و توسط سلول های اندوتلیال عروق خونی تولید می شود.
+ عمر NO کوتاه است و با اتصال به هموگلوبین پایدار و سبب تسهیل در تحویل بافتی آن می شود.
+ با اتصال NO به گیرنده خود در دیواره عروق خونی ، این عروق گشاد شده و تبادل گاز ها بین سلول های بافتی و خون تسهیل می شود.
پروتعین های پلاسمایی :
+ حدود 90درصد پلاسما را آب تشکیل می دهد و بقیه شامل مواد حل شده است.
+ بیش از 70 درصد مواد جامد پلاسما را پروتعین های خون تشکیل می دهند که به سه دسته تقسیم می شوند :
1- آلبومین
2- گلوبولین ها
3- فیبرینوژن
درباره peroda
توجه: این متن از پیشخوان>کاربران> ویرایش کاربری>زندگی نامه تغییر پیدا می کند. لورم ایپسوم متن ساختگی با تولید سادگی نامفهوم از صنعت چاپ، و با استفاده از طراحان گرافیک است، چاپگرها و متون بلکه روزنامه و مجله در ستون و سطرآنچنان که لازم است، و برای شرایط فعلی تکنولوژی مورد نیاز، و کاربردهای متنوع با هدف بهبود ابزارهای کاربردی می باشد.
نوشتههای بیشتر از perodaپست های مرتبط
28 آذر 1404
19 آذر 1404
17 آذر 1404
12 آذر 1404



دیدگاهتان را بنویسید