بیوشیمی ( پیوند پپتیدی ، ساختمان پروتعین ها )
8 آذر 1404
ارسال شده توسط peroda
پیوند پپتیدی ، ساختمان پروتعین ها
پروتعین ها از نظر اندازه ، ساختمان و درنتیجه فعالیت بیولوژیک بسیار متنوع هستند.
پروتعین ها حاصل پلیمریزاسیون اسید آمینه هستند و در ساختمان برخی اجزا غیر اسیدآمینه ای نظیر کربوهیدرات ها و فلزات وجود دارد که به تنوع ساختمانی و فعالیت آنها کمک میکند.
پروتعین ها برای عملکرد نیاز به شکل سه بعدی دارند.
اختلال در شکل گیری فضایی از دلایل مهم ناهنجاری های پروتعین است که این اختلال میتواند ناشی از جهش یا عوامل دیگر باشد.
برای اینکه یک پروتعین تشکیل شود باید چند آمینواسید در کنار یکدیگر قرار بگیرند و بین آنها پیوند پپتیدی تشکیل شود.
پیوند پپتیدی بین اتم C گروه کربوکسیل یک آمینواسید و اتم
N گروه آمین یک آمینواسید دیگر برقرار میشود.
20 آمینواسید معمول تنوع نامحدودی از نظر نوع و توالی قرارگیری در زنجیره پلی پپتید میدهد
که باعث ایجاد پروتعین هایی با ساختار و عملکرد متفاوت میشود.
به ازای هر پیوند پپتیدی یک مولکول آب تولید میشود.

با ایجاد یک زنجیره آمینواسیدی ، دو اسیدآمینه ابتدایی و انتهایی تنها در ایجاد یک پیوند پپتیدی شرکت نموده و یکی از گروه های کربوکسیلی یا آمینی شان آزاد است.
اولین آمینواسید این زنجیره دارای آمین آزاد است و انتهای آمینی زنجیره است و آخرین آمینواسید دارای
کربوکسیل آزاد است و انتهای کربوکسیلی را تشکیل میدهد.
ریشه های اسیدآمینه از انتهای آمین نامگذاری و شماره گذاری میشوند :

سریل گلیسیل تیروزیل آلانیل لوسین
پیوند بین نیتروژن و کربن a که زاویه چرخشش را فی (phi) میگویند.

پیوند بین کربن a و کربن کربونیل که زاویه چرخش این پیوند را سای میگویند.


پیوند میان اتم های C و N امکان چرخش را به اتم های مربوطه نمیدهد ، به همین دلیل برای پیوند پپتیدی دو کونفیگوراسیون سیس و ترانس میتوان در نظر گرفت.
A) سیس (cis) : در حالت سیس ، دو گروه جانبی ( R-گروه ها) در یک سمت پیوند پپتیدی قرار دارند که این حالت پایداری کمی دارد زیرا R گروه ها به هم نزدیک و دافعه فضایی افزایش می یابد.
B) ترانس : در حالت ترانس ، دو گروه جانبی( R-گروه های دو اسید آمینه) در دو طرف متقابل پیوند پپتیدی قرار میگیرند که این حالت پایدار تر است.
تمامی پیوندهای پپتیدی درون پروتعین از نوع ترانس هستند . بنابراین اتم های مربوط به پیوند همگی در یک صفحه قرار دارند.
زوایای چرخشی فی و سای (180- تا 180+ ) سبب شدند تا صفحات پپتیدی متوالی نسبت به یکدیگر زاویه دار باشند.

به زنجیره ای با 2 تا 10 آمینواسید الیگوپپتید ،
با 11 تا 50 آمینواسید پلی پپتید و
بیش از 50 آمینواسید پروتعین میگویند.
گلوتاتیون :
1- یک تری پپتید است که از آمینواسید های
گلوتامیک اسید ، سیستعین ، گلایسین تشکیل شده است.

2- گلوتاتیون به واسطه گروه سولفیدریل آزاد به عنوان
احیا کننده عمل می کند.
3- نقش
آنتی اکسیدانی قدرتنمدی دارد.
4- به دنبال اکسیداسیون ، دو مولکول گلوتاتیون از طریق یک پیوند
دی سولفیدی به یکدیگر متصل می شوند.
5- در حضور یک احیا کننده مناسب نظیر ( NADPH) گلوتاتیون اکسیده(GS-SG) مجدد به حالت احیا شده (GSH) تبدیل میشود.
6- بنابراین گلوتاتیون به عنوان یک سد دفاعی در برابر عوامل اکسیدان ( خنثی سازی یک پراکسید به هیدروکسید) عمل میکند.

هورمون آزادکننده تیروتروپین (TRH) :
1- یک تری پپتید است که از آمینواسید های
گلوتامیک اسید ، هیستیدین ، پرولین تشکیل شده است.

2- از هیپوتالاموس ترشح میشود و با اثر بر هیپوفیز باعث ترشح TSH میشود.
3- گلوتامیک اسید انتهای آمینو حلقوی شده و پیروگلوتامات را ایجاد میکند.
4- گروه کربوکسیل پرولین انتهای کربوکسیل به شکل آمیدی در آمده است.
تیتین بزرگترین پروتعین شناخته شده دارای 27000 ریشه اسید آمینه و در عضله وجود دارد.
انسولین کوچکترین پروتعین با 51 آمینواسید.
ساختمان های پروتعینی :
1- ساختمان اول :
A) تشکیل زنجیره پلی پپتیدی به دنبال تشکیل پیوند پپتیدی بین آمینواسید ها.
B) در دناتوره شدن پروتعین ها ( از دست رفتن کونفورماسیون و فعالیت پروتعین) ، ساختمان اول آنها حفظ میشود.
C) مهم ترین پیوند در تشکیل ساختمان اول پروتعین ، پیوند
کوالامید است.
2- ساختمان دوم :
A) تا خوردن قطعات کوتاه و هم جوار پلی پپتیدی به واحدهای منظم هندسی متوالی موجب ایجاد ساختمان دوم میشود.
B) اساس تشکیل ساختمان دوم پروتعین ها تشکیل پیوند
هیدروژنی است که به 4 صورت موجب تشکیل واحد های هندسی میشود
:
الف) Helix a ( مارپیچ آلفا) :
+ در این حالت ، برقراری پیوندهای هیدروژنی بین اتم های O و H زنجیره ی پلی پپتیدی موجب تشکیل ساختاری مانند
سیم پیچ یا استوانه می شود.
+ در مارپیچ آلفا عمدتاً اسیدهای آمینه
گلایسین و پرولین دیده نمی شود زیرا سبب ناپایداری مارپیچ می شود و در صورت حضور در مارپیچ ایجاد یک خم میکنند.
+ آمینواسید های
آلانین ، گلوتامات ، متیونین ، لوسین و فنیل آلانین بیشترین نقش را در مارپیچ آلفا دارند.
+ تنها شکل
راست گرد مارپیچ آلفا در پروتعین یافت می شود چون ثبات بیشتری دارد.
+ در مارپیچ راست گردان زنجیره های جانبی R ریشه های آمینواسید به سمت
خارج امتداد میابد.

+ تمامی زنجیره های پلی پپتیدی قادر به ایجاد مارپیچ a نیستند.
+ حدود
%14
زنجیره پلی پپتیدی آنزیم کیموتریپسین ، شکل مارپیچ آلفا دارد اما در
هموگلوبین و میوگلوبین این عدد به
%75 می رسد.
+ پیوند هیدروژنی بین اکسیژن کربونیل هر اسیدآمینه و هیدروژن آمیدی
چهارمین ریشه موجود در سمت انتهای کربوکسیل میباشد.
+
مارپیچ آلفا پایدارترین شکل ساختمان دوم پروتعینی است.

+ مارپیچ آلفا معمولاً در سطح پروتعین ها مشاهده میشود ولی ممکن است در داخل پروتعین ها نیز باشد.
+ مارپیچ آمفی پاتیک : حالتی است که آمینواسید های آبگریز در یک سمت مارپیچ و آبدوست در سمت دیگر قرار دارند که در محل تماس با هردو محیط قطبی و غیرقطبی مثلا در کانال های غشایی یافت میشود.
ب) Sheet B ( صفحات چین دار بتا) :
+ در این حالت ، برقراری پیوند های هیدروژنی بین اتم های O و H زنجیره ی پلی پپتیدی موجب ایجاد یک الگوی
زیگزاگی و چین دار میشود که به دو صورت
همسو و ناهمسو می شود .
+ در حالت همسو ، انتهای کربوکسیل و انتهای آمینی دو زنجیره ی پلی پپتیدی
در یک جهت هستند و در حالت ناهمسو بالاعکس.
+ در این حالت اسیدآمینه های
پرولین و گلایسین بیشتر دیده می شوند.
+ اکسیژن کربونیل و هیدروژن آمیدی دو یا چند زنجیره پلی پپتید
مجاور با یکدیگر ایجاد پیوند هیدروژنی میکنند و باعث ساختار صفحات و پایداری آن میشوند.
+ هر رشته خطی دارای دو انتهای آمین و کربوکسیل است. وجود این دو انتهای متفاوت سبب ایجاد
جهت یا قطبیت در زنجیر میشود.
+ رشته های مجزای بتا به ندرت در پروتعین وجود دارد چون پایداری کمی دارد ولی زمانی که کنار هم قرار میگیرند پیوند های هیدروژنی باعث پایداری آن میشود.

+ صفحات بتا همسو : پیوند های هیدروژنی به صورت مورب و در نتیجه طول پیوند
بیشتر و پیوند
ضعیف تر می شود و پایداری ساختار
کمتر است.

+ صفحات بتا نا همسو : پیوند های هیدروژنی به صورت عمود و
قوی تر است. بنابراین پایداری ساختار در این حالت
بیشتر است.

ج) پیچ ها و قوس ها :
+ پیچ ها و قوس ها با اتصال مارپیچ آلفا و صفحات بتا به یکدیگر باعث تا شدن زنجیره پلی پپتید و ایجاد
ساختار سه بعدی پروتعین می شود.
+ این ساختار
یک سوم ریشه های اسیدآمینه را در یک زنجیر پلی پپتیدی شامل می شود.
+ قوس ها اغلب حاوی ریشه های
آبدوست هستند و در سطح پروتعین و در تماس با آب قرار دارند و با آب ایجاد پیوند هیدروژنی میکنند.
+ به قوس هایی با کمتر از پنج ریشه آمینواسیدی
پیچ می گویند.
+ گلایسین به دلیل
کوچکی و انعطاف پذیری و پرولین به دلیل
کونفیگوراسیون اغلب در پیچ ها وجود دارند.

3- ساختار های فوق دوم :

A) موتیف ها (Motifs) :
الف) الگوهای کوچک و تکرار شونده در ساختمان پروتعین هستند.
ب) این ها قطعات کوچک اند اما شکل کلی پروتعین را میسازند.

B) دومِین ها (Domains) :
الف) بخش های بزرگتر و مستقل پروتعین هستند.
ب) چند موتیف کنار هم قرار میگیرند و یک دومین را تشکیل میدهند.
ج) هر دومین میتواند حتی اگر از بقیه پروتعین جدا شود ، بازهم عملکرد خاصی داشته باشد.

B) پروتعین های بزرگ (Large proteins) :
الف) معمولاً از چند دومین ساخته شده اند.
ب) در نهایت موجب ساخت یک پروتعین کامل میشود.
4- ساختمان سوم :
A) برقراری پیوند های مختلف غیرکوالانسی ( دی سولفیدی ، هیدروژنی ، یونی ، هیدروفوب) به خصوص دی سولفیدی بین بخش های مختلف یک زنجیره ی پلی پپتیدی باعث ایجاد یک شکل سه بعدی خاص میشود که موجب تشکیل ساختار سوم پروتعین میگردد.
B) دومین های پروتعین ها طی تشکیل ساختمان سوم پروتعین ساخته میشوند.
C) پیوند های یونی یا نمکی در پروتعین ها غالباً بین آمینواسیدهای
اسیدی و بازی تشکیل میشود.
D) در ساختمان سوم پروتعین ، آمینواسید های قطبی
نزدیک سطح قرار میگیرند و آمینواسید های غیرقطبی
درون مولکول جای میگیرند.
E) در بین پیوند های غیرکوالان ،
خاصیت آبگریزی بیشترین نقش را در ایجاد ساختمان سوم پروتعین ها دارد.
F) در پروتعین های بزرگ مثل میوگلوبین بیشتر اتصالات آبگریز و هرچه پروتعین کوچک تر باشد احتمال وجود اسیدآمینه آبگریز کمتر و پیوند های کوالان بیشتر است.
5- ساختمان چهارم :
A) پروتعین هایی که بیش از یک زنجیره پلی پپتید دارند.
B) پروتعین هایی که بیش از یک زیرواحد دارند ، پروتعین های
چنتایی یا مولتی مری هستند.
C) وقتی تعداد زنجیره ها کم باشد ممکن است از واژه
اولیگومر استفاده شود.
D) در پروتعین های چند زنجیره ای ، هر زیرواحد معمولاً وظیفه ی مشخصی دارد یا شکل خاصی دارد.
E) زیرواحد ها میتوانند
هم شکل(هومومر) یا
غیر هم شکل(هترومر) باشند.
F) هر زیرواحد میتواند فعالیت متفاوتی نسبت به زیرواحد دیگر داشته باشد.
G) برای نشان دادن تعداد زیرواحد های یک پروتعین ، معمولاً از حروف یونانی مثل آلفا ، بتا و ... استفاده میشود. مثلا a2 یعنی دو زیرواحد آلفا
H) گاهی چند زیرواحد کنار هم یک بخش تکراری میسازند که به این بخش تکراری
پروتومر میگویند.
I) هموگلوبین از دو زیرواحد آلفا(a) و بتا(B) تشکیل شده است . پس میگویند : a2B2 ، که یعنی 2تا آلفا + 2تا بتا
J) هر آلفا و بتا باهم یک واحد قوی میسازند . یک آلفا + یک بتا = تشکیل یک پروتومرaB ، پس هموگلوبین از دو پروتومر aB ساخته شده است.

صفحه ای بودن پیوند پپتیدی به دلیل رزونانس الکترونی است.
پیوند پپتیدی کوالانسی ، جزعی دوگانه و پلانار است.
پس از بیوسنتز برخی از پروتعین ها ، عمل گاما کربوکسیلاسیون روی آمینواسید های گلوتامات برای فعال شدن آنها صورت میگیرد و ویتامین K در این عمل به عنوان کوآنزیم شرکت میکند.
در بیماری آلزایمر ، تجمع پروتعین حاصل از folding نامناسب را داریم.
ساختمان اول انسولین :
+ انسولین کوچکترین پروتعین شناخته شده با 51 اسیدآمینه است.
+ ساختمان اول انسولین در گونه های مختلف تقریباً یکسان و بیشترین اختلاف در اسیدآمینه 8و9و10 زنجیره A و ریشه 30 زنجیره B
+ انسولین خوک کمترین تفاوت را با انسان دارد و فقط در اسیدآمینه 30 با انسان تفاوت دارد . ( در انسان Thr و در خوک Ala است )
+ انسولین گاوی در موقعیت های 8 و 10 ( به جای Thr و ile به ترتیب Ala و Val ) تفاوت دارد.

طبقه بندی پروتعین ها بر اساس شکل ظاهری :
1- پروتعین های رشته ای یا فیبری :
+ مثل کلاژن ، کراتین ، الاستین
+ دارای ساختمان امتداد یافته هستند و نسبت محوری آنها از 10 بیشتر است .
+ به دلیل داشتن تراکم بالایی از اسیدآمینه های آبگریز در داخل و در سطح خود در آب نامحلول هستند.
+ نقش ساختمانی دارند.
+ با اتصال زنجیره های پلی پپتیدی متعدد به هم از طریق سطوح آبگریز ایجاد کمپلکس سوپرا مولکول میکند. ( کمپلکس سوپرا یعنی یک مجموعه بزرگ از چند مولکول که بدون پیوند محکم ( کوالانسی) ، فقط با برهم کنش های ضعیف کنار هم جمع شده اند و باهم یک کار مشخص انجام میدهند)
2- پروتعین های گلبولی یا کروی :
+ دارای کروی متراکی بوده ، شکل تقریباً بیضی یا کروی دارند و امتداد یافته هستند و نسبت محوری آنها از 3 بیشتر نمیباشد.
+ در آب محلول هستند.
+ نقش های متنوعی مانند آنزیم ها ، پروتعین های انتقالی ، پروتعین های تنظیمی ، ایمنوگلوبین ها دارند.
+ در پروتعین کروی معمولاً قطعات مختلفی بر روی یکدیگر تا شده اند و یک ساختار سوم را ایجاد کرده اند.
+ در این حالت نواحی آبگریز در داخل پروتعین مدفون شده اند و نواحی آبدوست در سطح قرار میگیرند تا با آب تعامل کنند.
+ ساختار چهارم را دارند.
طبقه بندی پروتعین ها از نظر محتوا :
1- پروتعین های ساده :
+ برای فعالیت نیاز به جزء دیگری به جز آمینواسید ندارند.
2- پروتعین های مرکب :
+ برای فعالیت نیازمند اجزای غیر پروتعینی هستند.
+ جزء غیر پروتعینی اتصال محکم به پروتعین دارد و گروه پروستتیک نامیده میشود. ( یک مولکول کمکی کوچک که همیشه به پروتعین چسبیده است و کمک میکند پروتعین وظیفه اش را انجام دهد)

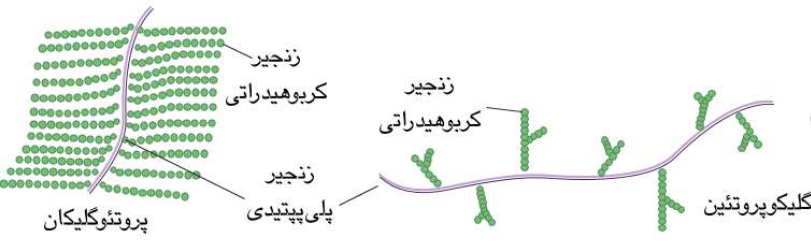
گلیکوپروتعین ها و پروتعوگلیکان ها :
1- گلیکوپروتعین ها :
+ گروه بسیار متنوعی از پروتعین هارا شامل می شوند که از اتصال زنجیر کوتاه کربوهیدرات به اسلت پلی پپتیدی حاصل می شود ؛ مثل آنتی بادی ها .
2- پروتعوگلیکان ها :
+ انواع دیگری از پروتعین های مرکب هستند که به بخش های کربوهیدراتی متصل می شوند.
+ در اینجا بخش قندی را پلیمری از واحد های دی ساکاریدی تکراری به نام گلیکوزآمینوگلیکان تشکیل می دهد.
لیپوپروتعین ها حاصل اتصال محکم لیپید ها به پروتعین ها هستند.
برای جا به جایی لیپید ها در خون نیاز به افزایش حلالیت آنها می باشد برای این منظور لیپوپروتعین ها به وجود می آیند.
اتصال بین لیپید و پروتعین غیر کووالان است.
ساختمان سه بعدی هر پروتعین توسط توالی آمینواسیدی آن و تعاملات بین آمینواسید ها مشخص می شود.
تعداد کونفورماسیون احتمالی حتی برای یک پپتید کوچک بی نهایت می باشد.
اگر ساختار اول پروتعین تخریب نشده باشد در بسیاری از موارد پروتعین ها می توانند به ساختار سه بعدی بومی خود بازگردند که این حالت را رناتوراسیون می گویند.
عوامل مهم دناتوراسیون پروتعین ها شامل :
1- تغییر PH
+ تغییر PH از طریق تغییر بار الکتریکی پروتعین ها باعث دناتوره شدن آنها می شود.
+ با کاهش PH پروتعین بار منفی خود را از دست می دهد درحالی که افزایش PH سبب کاهش بار مثبت پروتعین می شود.
+ در PH برابر با PI مقادیر برابر بار های مثبت و منفی در پروتعین وجود دارد که باعث ایجاد حداکثر پل های نمکی داخل مولکولی می شود.
+ بنابراین کمترین میزان حلالیت پروتعین در این PH می باشد.
+ این پل های نمکی ، مولکول های پروتعین را به یکدیگر متصل می کند و سبب تولید تجمعات نامحلول پروتعین می شود.
2- غلظت املاح
+ در غلظت پایین املاح محیط حلالیت پروتعین ضعیف است و با افزایش غلظت نمک حلالیت(حلالیت نمکی) افزایش می یابد.
3- حرارت
4- عوامل شیمیایی دناتوره کننده
عوامل موثر در تا شدن صحیح پروتعین ها :
1- چاپرون ها
+ سنتز اعضاء این خانواده پروتعینی با افزایش درجه حرارت افزایش می یابد و بر اساس وزن مولکولی نامگذاری شدند.
+ چاپرون ها از طریق مهار تا شدن غلط و مهار تشکیل تجمعات پروتعینی به ایجاد کونفورماسیون پروتعینی کمک می کند.
2- چاپرونین ها
+ چاپرونین فعالیت ATPase دارد و با هیدرولیز ATP به تا شدن پروتعین کمک می کند.
+ از چاپرون ها برای انتقال از عرض غشای میتوکندری و شبکه آندوپلاسمی استفاده می شود.
+ پروتعین ها به شکل تا نشده از غشای دولایه لیپیدی عبور می کنند و سپس به کمک چاپرون ها تا می شود.
3- پروتعین دی سولفید ایزومراز (PDI)
+ پروتعین دی سولفید ایزومراز با جا به جایی پیوند دی سولفیدی از انواع صحیح موجود در کونفورماسیون بومی را به وجود می آورد.
4- پروتعین شوک حرارتی (hsp)
5- پپتید پرولیل سیس - ترانس ایزومراز
بیماری های کونفورماسیونی :
1- بیماری آلزایمر
2- بیماری پارکینسون
2- بیماری جنون گاوی
پایان
درباره peroda
توجه: این متن از پیشخوان>کاربران> ویرایش کاربری>زندگی نامه تغییر پیدا می کند. لورم ایپسوم متن ساختگی با تولید سادگی نامفهوم از صنعت چاپ، و با استفاده از طراحان گرافیک است، چاپگرها و متون بلکه روزنامه و مجله در ستون و سطرآنچنان که لازم است، و برای شرایط فعلی تکنولوژی مورد نیاز، و کاربردهای متنوع با هدف بهبود ابزارهای کاربردی می باشد.
نوشتههای بیشتر از perodaپست های مرتبط
28 آذر 1404
19 آذر 1404
17 آذر 1404







دیدگاهتان را بنویسید